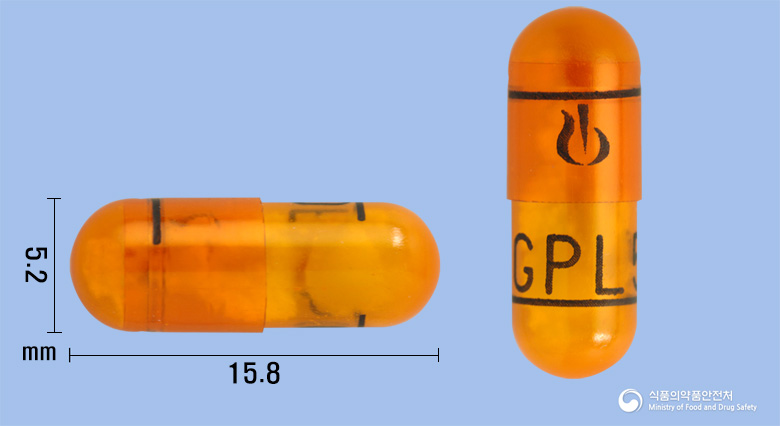
총량 : 이 약 1 캡슐 (74 밀리그램) 중 | 성분명 : 글리코피로니움브롬화물 | 분량 : 0.063 | 단위 : 밀리그램 | 규격 : 별규 | 성분정보 : 글리코피로니움으로서 50 마이크로그램 | 비고 :
기관지확장제로 만성폐쇄성폐질환의 증상 완화를 위한 유지요법제
성인
권장용량: 1일 1회, 이 약 1캡슐(글리코피로니움으로서 50마이크로그램)을 브리즈헬러(흡입기)에 장착하여 흡입한다.
최대 용량은 1일 1회, 글리코피로니움으로서 50마이크로그램이다.
이 약은 매일 같은 시간에 흡입하여야 하며, 투여를 놓친 경우 다음 용량을 최대한 빨리 투여한다. 이 약은 1일 1회를 초과하여 투여해서는 안 된다.
이 캡슐은 흡입기에 장착하여 흡입용으로만 사용하고 삼켜서는 안 된다.
고령자
75세 이상 고령자에게 투여 시 용량 조절은 필요하지 않다.
신장애 환자
경증 또는 중등증 신장애 환자에게 투여 시 용량조절은 필요하지 않다. 중증 신장애 또는 투석이 필요한 말기 신장 질환 환자의 경우, 전신노출이 2.2배까지 증가하였으므로 예측되는 유익성이 잠재적 위험성을 상회할 경우에만 투여하고, 발생 가능한 이상반응에 대해 면밀히 모니터링해야 한다. (5. 일반적주의 2)항 참조).
1. 경고
1) 이 약은 1일 1회 투여하는 기관지확장 유지요법제이므로 기관지의 급성 경련시 1차 치료약(응급약)으로 사용하지 않는다.
2) 이 약을 사용한 후 급성 과민반응이 보고된 바 있다. 특히 혈관부종(숨을 쉬거나 삼키는데 있어서 어려움을 느낄 경우, 혀, 입술, 얼굴의 부종을 포함), 두드러기, 또는 피부발진과 같은 알러지 반응을 시사하는 징후가 나타날 경우, 이 약의 투여를 즉시 중단하고 다른 치료를 실시해야 한다.
3) 다른 흡입요법과 마찬가지로 이 약은 치명적인 기이성기관지연축(paradoxic bronchospasm)을 일으킬 수 있다. 이러한 증상이 발생할 경우에는 이 약 투여를 즉시 중단하고 다른 치료를 실시해야 한다.
4) 다른 항콜린성 의약품과 마찬가지로, 협우각 녹내장 환자나 요정체 환자는 이 약을 사용할 때 주의해야 한다.
환자는 이 약의 분말이 눈으로 들어가지 않도록 주의해야 한다. 환자에게 급성 협우각 녹내장의 징후 및 증상에 대하여 알려주고, 징후 및 증상이 발생할 경우에는 이 약 투여를 즉시 중단하고 의사와 상의하도록 해야 한다.
2. 다음 환자에는 투여하지 말 것
1) 이 약 또는 이 약의 구성성분에 과민증이 있는 환자
2) 이 약은 유당을 함유하고 있으므로, 갈락토오스 불내성(galactose intolerance), Lapp 유당분해효소 결핍증(Lapp lactase deficiency) 또는 포도당-갈락토오스 흡수장애(glucose-galactose malabsorption) 등의 유전적인 문제가 있는 환자에게는 투여하면 안 된다.
3. 다음 환자에는 신중히 투여할 것
1) 불안정 허혈성 심장질환, 좌심실부전, 심근경색, 부정맥, QT 연장 증후군 등 심혈관계 질환 환자(일반적주의 1)항 참조)
2) 협우각 녹내장 환자
3) 요정체 환자
4) 중증 신장애 또는 투석이 필요한 말기 신장 질환 환자(일반적주의 2)항 참조)
5) 이 약은 황색5호(선셋옐로우 FCF, Sunset Yellow FCF)를 함유하고 있으므로 이 성분에 과민하거나 알레르기 병력이 있는 환자에는 신중히 투여한다.
4. 이상반응
1) 만성폐쇄성폐질환 환자 1,353명에게 권장 용량인 1일 1회 50µg을 투여하여 연구하였다. 이들 중 842명은 26주 이상 동안 치료를 받았으며, 351명은 52주 이상 동안 치료를 받았다.
이 약의 안전성 프로파일은 항콜린제 특성에서 기인했다고 볼 수 있다. 그 중 구강 건조증이 있으며 다른 위장관 효과나 요정체가 흔하지 않게 나타났다. 국소적 내약성에 관한 약물 이상반응에는 인후 자극, 비인두염, 비염 및 부비동염이 있었다.
2) 이 약을 중등증~중증의 만성폐쇄성폐질환 환자에게 각각 6개월, 12개월 동안 투여한 두 개의 3상 임상시험의 첫 6개월 안전성 자료를 통합한 결과를 MedDRA system 신체기관 분류에 따라 분류기재하였다. 각 신체기관 분류에서 이상반응을 발현 빈도 및 중증도에 따라 내림차순으로 기재하였다. 빈도는 다음과 같이 정의된다: 매우 흔하게(≥1/10), 흔하게(≥ 1/100, < 1/10), 흔하지 않게(≥1/1,000, < 1/100)
| 이상반응 |
이 약 1일 1회 50µg n=1,075 |
위약 n=535 |
발생 빈도 |
| N(%) |
N(%) |
||
| 위장관계 이상 |
|||
| - 구강 건조증 |
26 (2.4) |
6 (1.1) |
흔하게 |
| - 위장염 |
15 (1.4) |
5 (0.9) |
흔하게 |
| - 소화불량 |
8 (0.7) |
2 (0.4) |
흔하지 않게 |
| - 충치 |
4 (0.4) |
0 (0) |
흔하지 않게 |
| 정신계 이상 |
|||
| - 불면증 |
11 (1.0) |
4 (0.8) |
흔하게 |
| 근골격 및 결합 조직 이상 |
|||
| - 팔다리 통증 |
10 (0.9) |
1 (0.2) |
흔하지 않게 |
| - 근골격계 흉통 |
8 (0.7) |
3 (0.6) |
흔하지 않게 |
| 피부 및 피하 조직 이상 |
|||
| - 발진 |
10 (0.9) |
2 (0.4) |
흔하지 않게 |
| 전신 및 투여 부위 이상 |
|||
| - 피로 |
9 (0.8) |
3 (0.6) |
흔하지 않게 |
| - 무력증 |
8 (0.7) |
2 (0.4) |
흔하지 않게 |
| 호흡기계, 흉부 및 종격동 이상 |
|||
| - 굴울혈(Sinus congestion) |
8 (0.7) |
2 (0.4) |
흔하지 않게 |
| - 젖은 기침 |
7 (0.7) |
1 (0.2) |
흔하지 않게 |
| - 인후 자극 |
6 (0.6) |
1 (0.2) |
흔하지 않게 |
| - 코피 |
3 (0.3) |
1 (0.2) |
흔하지 않게 |
| 감염 |
|||
| - 비염 |
8 (0.7) |
2 (0.4) |
흔하지 않게 |
| - 방광염 |
3 (0.3) |
0 (0) |
흔하지 않게 |
| 대사 및 영양 이상 |
|||
| - 고혈당증 |
8 (0.7) |
2 (0.4) |
흔하지 않게 |
| 신장 및 요로계 이상 |
|||
| - 배뇨 곤란 |
7 (0.7) |
1 (0.2) |
흔하지 않게 |
| - 요정체 |
2 (0.2) |
0 (0) |
흔하지 않게 |
| 심장 이상 |
|||
| - 심방세동 |
6 (0.6) |
0 (0) |
흔하지 않게 |
| - 두근거림 |
2 (0.2) |
0 (0) |
흔하지 않게 |
| 신경계 이상 |
|||
| - 감각 저하 |
6 (0.6) |
0 (0) |
흔하지 않게 |
12개월 연구에서 위약보다 빈도가 높았던 추가적인 이상반응은 다음과 같다: 비인두염(9.0% 대 5.6%), 구토(1.3% 대 0.7%), 근골격 통증(1.1% 대 0.7%), 경부 통증(1.3% 대 0.7%), 당뇨(0.8% 대 0%)
3) 자발 보고와 문헌 사례에서 나타난 이상반응(빈도는 알려지지 않음)
시판 후 자발 보고와 문헌 사례에서 나타난 이 약의 이상반응은 다음과 같다.
이 이상반응들은 규모가 정확하지 않은 집단으로부터 자발적으로 보고되었으므로, 신뢰성 있는 빈도를 예측하기 어려워 빈도는 알려지지 않음으로 분류하였다. MedDRA 기관계 순서에 따라 이상반응을 나열하였다. 동일 기관계에서는 중증도가 감소하는 순으로 나열하였다.
자발적 보고로부터의 이상반응
| 면역계 이상 |
혈관부종, 과민반응 |
| 호흡기, 흉부, 종격동 이상 |
기이성기관지연축, 발성장애 |
| 피부 및 피하조직 이상 |
소양증 |
4) 가장 흔하게 발생한 항콜린제 이상반응은 구강 건조증이었다. 이 중 대부분은 약물로 인한 것이었으며 경증이었고 중증은 없었다. 발진이 흔하지 않게 나타났는데 대개 경증이었다.
5) 75세 이상의 고령 환자의 경우 요로 감염 및 두통 발생 빈도는 이 약 투여시 위약보다 더 높았다. (각각 3.0% 대 1.5%, 2.3% 대 0%)
5. 일반적 주의
1) 불안정 허혈성 심장 질환, 좌심실부전, 심근경색, 부정맥(안정적인 만성 심방세동 제외), QT 연장 증후군 또는 QTcF 가 연장(> 450ms 인 남성 또는 > 470ms 인 여성)된 피험자는 이 약의 임상시험에서 제외되었으므로, 이러한 환자에서의 사용경험이 제한적이다. 따라서 이러한 환자들은 이 약을 사용할 때 주의해야 한다.
2) 신장애는 이 약의 전신 노출에 영향을 미친다. 경증 및 중등증 신장애 환자의 경우 AUClast가 평균 1.4배까지 증가했으며, 중증 및 말기 신장 질환 환자의 경우 2.2배까지 증가하였다. 집단 약동학 분석 결과, 경증 및 중등증 신장애(예상 사구체 여과율 eGFR≥30 mL/min/1.73m2) 환자는 이 약을 권장 용량으로 사용할 수 있다. 그러나, 투석이 필요한 말기 신장 질환 환자를 포함하여 중증 신장애(eGFR < 30mL/min/1.73m2) 환자의 경우 예측되는 유익성이 잠재적 위험성을 상회하는 경우에만 사용해야 한다. 이러한 환자에게 투여시 발생 가능한 이상반응에 대해 면밀히 모니터링해야 한다.
3) 간장애 환자를 대상으로 한 임상시험은 수행되지 않았다. 그러나 이 약은 대부분 신장으로 배설되어 제거되므로 간장애 환자에서 전신 노출이 크게 증가하지는 않을 것으로 예상된다.
6. 상호작용
1) 이 약과 다른 항콜린제와의 병용투여에 대해서는 연구된 바가 없으므로 다른 항콜린제와 마찬가지로 병용투여가 권장되지 않는다.
2) 임상시험에서 이 약과 속효성/지속성 베타2-아드레날린성 작용제 (인다카테롤 포함), 메틸잔틴계 약물, 경구/흡입용 스테로이드를 병용투여 하였을 때 약물이상반응의 증가는 나타나지 않았다.
3) 이 약과 베타2-아드레날린성 작용제인 경구 흡입용 인다카테롤을 정상 상태(steady-state)에서 병용투여시 두 약물의 약물동태에는 영향이 없었다.
4) 건강한 지원자들을 대상으로 실시한 임상시험에서 이 약의 신배설에 기여하는 것으로 알려져 있는 유기 양이온 수송 과정을 억제하는 시메티딘이 이 약의 총 노출(AUC)을 22% 증가시키고 신청소율(CLcr)을 23% 감소시켰다. 이러한 결과에 근거할 때, 이 약을 시메티딘이나 다른 유기 양이온 수송 작용 억제제와 병용투여시 임상적으로 유의한 상호작용은 나타나지 않을 것으로 예상된다.
5) in vitro 연구에서 이 약은 다른 약물의 대사 또는 약물 수송체를 유도/억제하지 않는 것으로 나타났다. 다양한 효소가 관련된 대사는 이 약의 배설에 부차적인 역할을 하기 때문에 이 약의 대사를 유도 또는 억제하는 것은 이 약의 전신 노출에 유의한 영향을 미치지는 않을 것이다.
7. 임부 및 수유부에 대한 투여
1) 임부: 이 약을 임부에게 투여한 임상자료는 자료는 없다. 랫드나 토끼에게 이 약을 흡입 투여시 기형은 나타나지 않았다. 이 약은 임부에 대해 예측되는 유익성이 태아에 대한 잠재적 위험성을 상회한다고 판단되는 경우에만 투여해야 한다.
2) 수유부: 이 약이 모유로 이행되는지 여부는 알려지지 않았다. 그러나 수유중인 랫드의 경우 글리코피로니움(대사산물 포함)이 젖으로 분비되었다. 이 약은 수유부에 대해 예측되는 유익성이 영아에 대한 잠재적 위험성보다 훨씬 클 경우에만 사용을 고려해야 한다.
3) 수태능: 동물을 대상으로 한 연구 및 기타 데이터에 따르면 수컷 및 암컷에서 이 약으로 인한 수태능에 대한 우려는 없다.
8. 소아에 대한 투여
이 약은 소아에게 투여하지 않는다.
9. 과량 투여시의 처치
1) 이 약을 고용량 투여할 경우 증상의 치료가 필요할 수도 있는 항콜린성 증상 및 징후가 나타날 수도 있다.
2) 만성폐쇄성폐질환 환자에게 이 약을 28일 동안 1일 1회, 1회 100µg 및 200µg로 반복 경구 투여한 결과 양호한 내약성을 보였다.
3) 이 약은 경구 생물학적 이용도(약 5%)가 낮으므로 실수로 캡슐을 경구 투여하여도 급성 중독증은 발생하지 않을 것이다.
4) 건강한 지원자에게 글리코피로니움으로서 120µg을 정맥 내 투여 후 최고 혈장 농도 및 총 전신 노출량은, 이 약의 권장 용량(1일 1회 50µg) 투여시 얻어진 정상 상태에서의 최고 혈장 농도 및 총 전신 노출량보다 각각 약 50배, 6배 많았으며, 양호한 내약성을 보였다.
10. 적용상의 주의
1) 이 약은 브리즈헬러(흡입기)를 이용하여 경구 흡입으로만 투여한다.
2) 이 약을 삼켜서는 안 된다.
3) 이 약은 습기를 피할 수 있도록 항상 원래 포장(블리스터) 상태로 보관해야 하며, 흡입하기 바로 직전에 포장을 제거하여야 한다.
4) 브리즈헬러(흡입기) 사용 방법은 다음과 같다.
① 브리즈헬러의 뚜껑을 위로 당겨 분리한다.
② 브리즈헬러 열기: 브리즈헬러를 단단히 잡고 흡입구를 젖혀서 브리즈헬러를 연다.
③ 캡슐 준비: 흡입하기 직전에 마른 손으로 캡슐을 블리스터에서 꺼낸다.
④ 캡슐 넣기: 캡슐을 브리즈헬러의 캡슐 챔버에 넣는다. 캡슐을 흡입구에 직접 넣어서는 안 된다.
⑤ 브리즈헬러 닫기: 딱 소리가 나도록 브리즈헬러를 닫는다.
⑥ 캡슐 뚫기: 흡입구가 위를 향하도록 브리즈헬러를 잡고, 양쪽의 버튼을 동시에 완전히 눌러 캡슐을 뚫는다. 이 동작은 단 한번만 한다. 캡슐이 뚫릴 때 딱소리가 나야 한다.
⑦ 눌렀던 양쪽의 버튼을 놓는다.
⑧ 숨 내쉬기: 브리즈헬러의 흡입구를 입에 대기 전에 숨을 완전히 내쉰다. 흡입구로 숨을 내쉬어서는 안 된다.
⑨ 흡입하기: 브리즈헬러의 양 버튼이 오른쪽-왼쪽으로 위치하게 잡고, 버튼은 누르지 않는다. 흡입구를 입에 넣은 후 입술을 다문다. 빠르지만 안정되게, 가능한 한 깊이 흡입한다.
⑩ 브리즈헬러를 통해 흡입할 때 챔버에서 캡슐이 회전하므로, 회전하는 소리가 들려야 한다. 이 약은 폐로 들어갈 때 달콤한 향이 난다.
● 가끔 캡슐의 아주 작은 조각이 막을 통과하여 입으로 들어갈 수 있다. 이 때 혀에서 이 조각이 느껴질 수 있다. 이 조각은 삼키거나 흡입하여도 무해하다. ⑥에서 캡슐을 뚫는 동작이 한 번을 초과하여 하였을 때 캡슐이 부서질 확률이 높다.
● 회전소리가 들리지 않을 때: 캡슐이 캡슐 챔버에 고정되어 있을 수 있다. 이 경우 브리즈헬러를 열고 브리즈헬러를 톡톡 두드려 캡슐을 느슨하게 한다. 이 때 양 버튼을 눌러서는 안 된다. ⑧, ⑨를 반복하여 이 약을 흡입한다.
⑪ 숨 참기: 이 약을 흡입한 후, 브리즈헬러를 입에서 뗀 후 최소 5~10초 또는 편안하게 참을 수 있는 한 오래 숨을 참는다. 그리고 숨을 내쉰다. 브리즈헬러를 열고 캡슐에 남은 분말이 있는지 확인한다. 만약 캡슐에 분말이 남아 있다면, 브리즈헬러를 닫고 ⑧, ⑨, ⑩, ⑪을 반복한다. 대부분 한 번 또는 두 번의 흡입으로 캡슐의 분말을 완전히 흡입할 수 있다.
● 이 약 흡입 후 짧은 기침을 하는 경우가 가끔 있으나, 우려하지는 않아도 된다. 캡슐이 비어 있다면 충분한 양의 약물이 흡입된 것이다.
⑫ 이 약의 흡입을 완료한 후, 흡입구를 다시 열고 브리즈헬러를 기울여 빈 캡슐을 캡슐 챔버에서 꺼낸다. 브리즈헬러를 닫고 뚜껑을 덮는다. 캡슐을 브리즈헬러 안에 두어서는 안 된다.
⑬ 일지 작성: 다음 복용일을 기억하기 쉽게 하기 위해 동봉된 일지에 오늘의 복용여부를 기록한다.
5) 이 약을 처방받은 환자는 브리즈헬러의 정확한 사용방법에 대해 교육을 받아야 한다. 환자가 호흡에 있어서 개선사항이 없는 경우 이 약을 흡입하지 않고 삼켰는지에 대해 환자에게 문의해야 한다.
6) 30일 이상 사용한 브리즈헬러는 폐기한다.
11. 보관 및 취급상의 주의사항
1) 어린이의 손이 닿지 않는 곳에 보관한다.
2) 의약품을 원래 용기에서 꺼내어 다른 용기에 보관하는 것은 의약품 오용에 따른 사고 발생이나 의약품 품질 저하의 원인이 될 수 있으므로 원래의 용기에 보관한다.
3) 브리즈헬러는 물로 세척하면 안 된다. 브리즈헬러에 남아 있는 분말을 제거할 때는 깨끗하고 마른 천으로 흡입구 안과 바깥을 닦아 낸다. 브리즈헬러는 건조한 상태를 유지하여야 한다.
| 저장방법 | 기밀용기, 습기를 피하여 25℃ 이하 보관 |
| 사용기간 | 제조일로부터 24개월 |
| 재심사대상 | 재심사대상(6년잔여) [2016-04-11 - 2020-05-22] |
| RMP대상 | |
| 포장정보 | 30캡슐(10캡슐/PTP포장X3, 6캡슐/PTP포장X5) |
| 보험코드 | 653602741 |
| 보험약가 | 38422 / 캡슐/팩 |
| 보험적용일 | 2017-02-01 |
서울 부산 인천 대구 광주 대전 울산 경기 강원 충북 충남 전북 전남 경북 경남 제주 세종시



